Odhalení klíčových genů souvisejících s poškozením DNA a lidskými nemocemi
3.6.2024 | Petr Žák
V nové studii publikované v únoru v časopise Nature vědci z Wellcome Sanger Institute, jejich spolupracovníci z UK Dementia Research Institute na University of Cambridge a dalších organizací (celkem 45 autorů) identifikovali 145 klíčových genů spojených s poškozením DNA a lidskými nemocemi. V rámci této studie bylo systematicky prozkoumáno téměř 1 000 geneticky modifikovaných myších linií, což poskytlo hluboký vhled do mechanismů genomické nestability, postupu rakoviny, neurodegenerativních nemocí a možných terapeutických přístupů k nim.
Genomická nestabilita, projevující se náchylností DNA k častějším chybám a změnám, je úzce spjata s tvorbou mikrojader a představuje klíčový znak stárnutí a mnoha onemocnění, včetně rakoviny, zánětlivých onemocnění a vývojových poruch.
Mikrojádra (MN, micronuclei) vznikají v důsledku chyb v mitotickém dělení nebo z neopravených zlomů DNA, které vedou k mitotickým chromozomálním můstkům a událostem typu zlom-fúze-most. Tato miniaturní jádra obsahují chybně umístěný genetický materiál, který by měl být v buněčném jádru, ale nachází se volně v cytoplazmě buňky. Jsou chráněna atypickým jaderným obalem a mohou přetrvávat po několik buněčných cyklů, přičemž získávají abnormální epigenetické chromatinové značky, které se mohou přenášet i na další generace buněk. Mikrojádra jsou schopna replikovat svou DNA, i když asynchronně a pomaleji než jaderná DNA.
Poškození mikrojader může vést k prasknutí jejich jaderného obalu, což dále indukuje hromadění poškození DNA a následnou chromozomální rekombinaci (chromotripse, chromothripsis). Zároveň dochází k silné prozánětlivé reakci zprostředkované enzymem cGAS (cyklický GMP-AMP syntáza), která může vést k buněčnému stárnutí. Přestože mikrojádra představují známý znak stárnutí a nemocí spojených s genomickou nestabilitou, genetické faktory regulující jejich tvorbu dosud nebyly plně objasněny.
Aby vědci identifikovali faktory, které mohou regulovat tvorbu mikrojader in vivo, provedli screening více než 6000 myší (997 různých mutantních myších linií) pomocí vysoce citlivé detekční metody, která počítá mikrojádra v červených krvinkách pomocí průtokové cytometrie (Obr. 2). Identifikovali 145 genů, jejichž ztráta významně zvyšuje nebo snižuje tvorbu mikrojader. Mnohé z těchto genů mají své obdoby (ortology) spojené s lidskými nemocemi.
Výsledky byly rozděleny do tří úrovní na základě statistické významnosti:
- Kategorie 1: 56 genů (P < 0,001)
- Kategorie 2: 49 genů (P < 0,005)
- Kategorie 3: 40 genů (P < 0,01)
Výzkum ukázal, že geny zapojené do kohezivního spojení sesterských chromatid (SCC - Sister Chromatid Cohesion), jako jsou DSCC1, Esco1, Smc3, Sgo1/Sgol1 a Pds5b, hrají důležitou roli v regulaci tvorby mikrojader. Defekty v lidských protějšcích několika těchto genů způsobují multiorgánové syndromy nazývané kohesinopatie (genetické poruchy způsobené dysfunkcí kohesinových proteinů), které jsou spojeny s vývojovými a skeletálními abnormalitami, kardiovaskulárními anomáliemi (Obr. 1), viscerálními defekty a také s behaviorálními a neurologickými poruchami. Vyřazení genu DSCC1 u myší pětinásobně zvýšilo tvorbu abnormálních mikrojader a vedlo k charakteristikám podobným lidským pacientům s kohesinopatiemi, což ukazuje na klíčovou roli tohoto genu v udržování genomové stability.
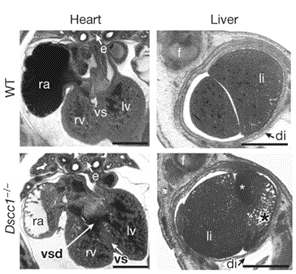
Obr. 1: Abnormality srdce a jater u myších embryí Dscc1-/- E14,5. Vlevo dole defekt komorového septa (vsd) u embrya Dscc1-/-. Vpravo dole abnormální struktura jater, konkrétně cysta (bílá hvězdička) a abnormálně zvětšené jaterní sinusoidy v kombinaci se sníženým počtem hepatocytů (černá hvězdička) v jaterním laloku embrya Dscc1-/-.
Pomocí CRISPR screeningu vědci ukázali, že efekt způsobený ztrátou DSCC1 lze částečně zvrátit inhibicí proteinu SIRT1. To nabízí slibnou cestu pro vývoj nových terapií. Inhibitory SIRT1 představují potenciální terapeutickou možnost pro léčbu kohesinopatií a dalších genomových poruch. Včasný zásah zaměřený na SIRT1 by mohl zmírnit biologické změny spojené s genomovou nestabilitou, než se tyto změny plně rozvinou.
Výzkum genetických modelů, které propojují tvorbu mikrojader s jejich následky, poskytuje důležité informace pro pochopení lidských nemocí. Tento výzkum ukazuje, jak mohou genetické studie přispět k lepšímu porozumění nemocem a vývoji nových léčebných metod, což může výrazně zlepšit zdravotní péči.
Studie vyzdvihuje důležitost genetického výzkumu pro vývoj personalizovaných léčebných přístupů. Identifikace konkrétních genů spojených s nemocemi může vést k vytvoření cílených terapií, které by zlepšily výsledky léčby a kvalitu života pacientů.
Výsledky studie poskytují cenné informace o genetických faktorech, které ovlivňují zdraví lidského genomu během života a vývoje nemocí. To může vést k lepším diagnostickým nástrojům a preventivním opatřením. Inhibitory SIRT1 představují slibnou terapeutickou možnost pro léčbu kohesinopatií a dalších genomických poruch. Tím se otevírá nová cesta pro vývoj léků, které by mohly specificky cílit na genetické faktory způsobující nemoc.
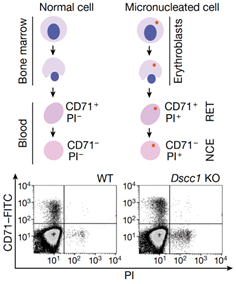
Obr. 2: Schéma testu in vivo. Jsou zobrazeny údaje pro myš Dscc1 -– knock out (KO) a kontrolní skupinu -– wilde-type (WT). CD71 - transferinový receptor; NCE - normochromatický erytrocyt; PI - propidium jodid; RET - retikulocyt.
Zdroje: