První léčba genovou editací aplikovaná do krve snižuje množství toxických bílkovin až na jeden rok
13.6.2022 |
První tým, který deaktivoval gen způsobující onemocnění prostřednictvím infuze editačního systém CRISPR přímo do pacienta, oznámil, že hladiny cílového, toxického TTR proteinu hrajícího klíčovou roli při vzniku transtyretinové srdeční amyloidózy (ATTR) klesly na mnoho měsíců až o 93 %. Vědci doufají, že dlouhodobé snížení znamená, že pacienti v klinické studii brzy prokáží i jasné zlepšení jejich nervových symptomů a že tato příznivá situace přetrvá po delší dobu.
Nástroj pro úpravu genů CRISPR zaznamenal první klinické vítězství v roce 2020, kdy se ukázalo, že dokáže vyléčit lidi se dvěma dědičnými poruchami krve, srpkovitou anémií a beta-talasemií. Vlastní „léčba“ probíhala v laboratorní misce - vědci odebrali pacientům defektní krevní kmenové buňky, upravili je a znovu je pacientům vpravili do krve. Editace genů by mohla řešit mnohem více nemocí, pokud by terapie mohla být aplikována do orgánu nebo krevního řečiště. Ale přimět CRISPR, aby fungoval in vivo, uvnitř člověka, představuje značné problémy. Předtím, než molekulární komponenty CRISPR mohou správně modifikovat cílový gen, musí být bezpečně dopraveny do správných buněk ve správném množství.
Vědci ale i zde postoupili o krok dál a použili už CRISPR přímo v těle pacientů. V malých studiích tato strategie snížila obsah toxického jaterního proteinu a mírně zlepšila zrak u lidí s dědičnou slepotou . Nyní přináší výrazný posun studie zaměřená na ATTR.
ATTR je vzácné, progresivní onemocnění, při kterém dochází k chybnému složení proteinu známého jako TTR a jeho hromadění v podobě plaků v tkáních po celém těle. To způsobuje závažné komplikace, které se týkají především srdce a nervů, a většina pacientů umírá 2-15 let po začátku onemocnění. ATTR se vyskytuje v dědičné formě (ATTRv) a získané formě (ATTRwt), která se může objevit s vyšším věkem. Přesná data nejsou známa, ale odhaduje se, že ATTRv trpí na celém světě 50 000 lidí. Léčebné možnosti nyní zahrnují několik nových léků, které zasahují do amyloidogeneze na různých úrovních a různými mechanismy.
V loňském roce pak začaly společnosti Intellia Therapeutics a Regeneron Pharmaceuticals pacientům s ATTR injekčně podávat tukové částice nesoucí messenger RNA, kódující enzym Cas9 štěpící DNA a naváděcí vlákno RNA, které zapříčiní „přestřižení“ genu kódujícího protein TTR v játrech; buňky pak neopravují zlom bezchybně, což znemožní na genové úrovni produkci škodlivého proteinu.
V roce 2021 společnosti oznámily, že jeden měsíc poté, co šest pacientů dostalo injekci této in vivo léčby pomocí CRISPRu, jejich krevní hladiny TTR prudce klesly. Přestože dosud nebylo zdokumentováno zlepšení příznaků pacientů, někteří vědci označili tyto výsledky spolu s ranými údaji z další studie, v níž byla in vivo aplikace CRISPR konstruktu využita k léčbě dědičné slepoty, za jednoho z možných finalistů v soutěži Průlom roku 2021 (nakonec byla za Průlom roku 2021 označena technologie výpočtu 3D struktury proteinů s využitím umělé inteligence).
V tiskové zprávě aktualizující dosažené výsledky společnosti uvedly, že léčba stále nevedla k žádným velkým bezpečnostním problémům. Krevní hladiny TTR dosahovaly v průměru jen 7 % až 59 % jejich hladin před léčbou, v závislosti na tom, kterou ze čtyř dávek CRISPR lidé dostali a zůstaly stabilní u celkem 15 lidí léčených o 2 až 12 měsíců dříve. Ti, kteří dostali nejvyšší dávku a měli nejnižší hladiny TTR, dostali infuzi až o 6 měsíců dříve.
Trvalé snížení bylo to, co společnosti očekávaly na základě dřívějších testů na myších a opicích. Stále však zůstávala možnost, že když se upravené jaterní buňky člověka obmění (k čemuž dochází po 200 až 300 dnech), vysoké hladiny TTR by se mohly vrátit, pokud by se objevily nové buňky, ve kterých neproběhla editace. „Čekali jsme na definitivní odpověď,“ vysvětlil prezident a generální ředitel společnosti Intellia John Leonard.
Vědci zatím nevědí, zda se pacientům, kteří již mají bolesti nervů a necitlivost v celém těle, zlepší neurologické testy, nebo zda léčba může nemoc pouze stabilizovat. Protože periferní nervy, které se podílejí na bolesti a necitlivosti, potřebují čas, než se zotaví z nahromadění TTR, tyto testy se obvykle provádějí jeden rok po léčbě.
Schválené léky, které snižují hladinu TTR o 80 %, vedou ke zlepšení symptomů, což podněcuje optimismus, že CRISPR udělá totéž s jednorázovou léčbou. "Myslím, že lidé obecně předpokládají, že klinické výsledky budou následovat," říká výzkumník v oblasti genové úpravy a kardiolog Kiran Musunuru z Pensylvánské univerzity, který pracuje na léčbě srdečních onemocnění pomocí CRISPR, která se také podává přímo pacientovi.
V současné době společnosti pokračují v přijímání pacientů s ATTR s rozsáhlou bolestí nebo necitlivostí nervů a také lidí se srdeční formou onemocnění. Společnost Intellia také používá podobnou léčbu využívající CRISPR k úpravě jaterního genu u lidí s dědičným angioedémem, který způsobuje silné otoky končetin a dýchacích cest.
Navzdory pokrokům v klinické praxi se však společnost potýká s možnými obchodním komplikacemi spojenými s bitvou o patentová práva mezi Kalifornskou univerzitou v Berkley a Broad Institue of MIT and Harvard.
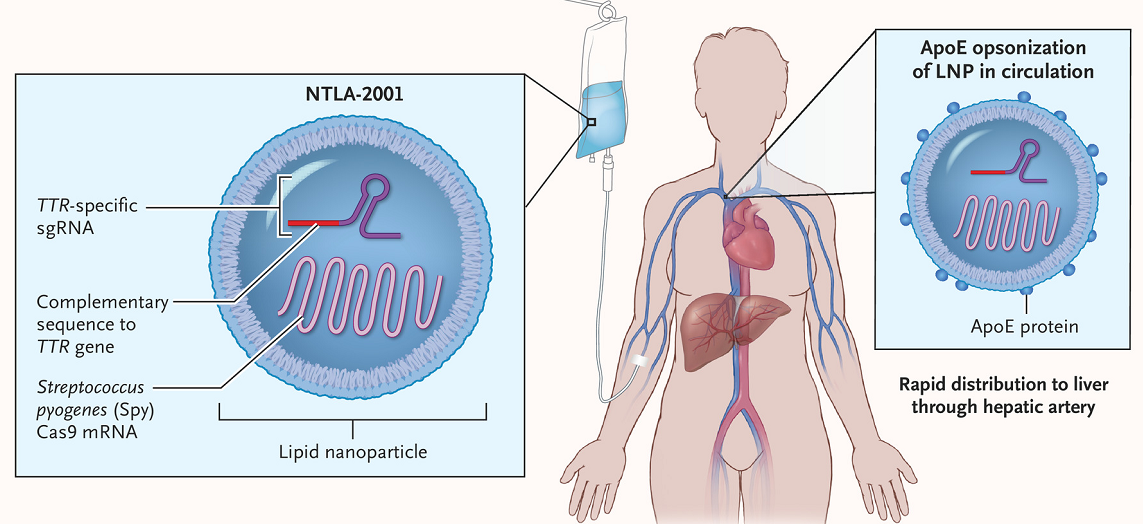
Obr. 1: Intravenózní infuze přípravku
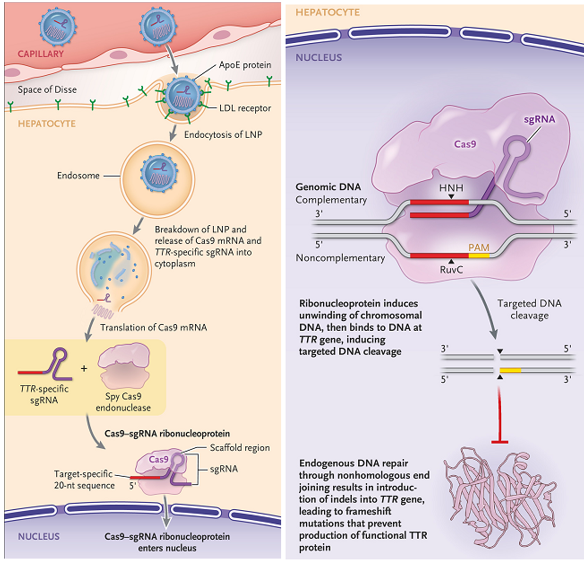
Obr.2: Vstup přípravku do hepatocytů (vlevo) a štěpení DNA v sekvenci genu ttr pomocí Cas9
Zdroje:
- https://www.science.org/content/article/first-gene-editing-treatment-injected-blood-reduces-toxic-protein-1-year
- https://www.science.org/content/article/crispr-injected-blood-treats-genetic-disease-first-time
- https://www.nejm.org/doi/full/10.1056/NEJMoa2107454